材料一《义务教育化学课程标准(2011年版)》关于“质量守恒定律”的内容标准:认识质量守恒定律,能说明化学反应中的质量关系;活动与探究建议:实验探究化学反应前后的质量关系。
材料二某化学教科书的部分目录:
绪言化学使世界变得更加绚丽多彩
第一单元走进化学世界
第二单元我们周围的空气
第三单元物质构成的奥秘
第四单元自然界的水
第五单元化学方程式
课题1质量守恒定律
课题2如何正确书写化学方程式
课题3利用化学方程式的简单计算
材料三某化学教科书中有关“质量守恒定律”的实验片段如下:
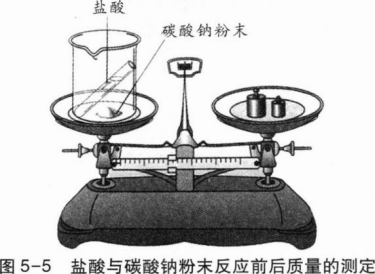
实验5-1把盛有盐酸的小试管小心地放入装有碳酸钠粉末的小烧杯中,将小烧杯放在托盘天平上用砝码平衡(如图5—5)。取下小烧杯并将其倾斜,使小试管中的盐酸进入小烧杯中,观察现象。
反应进行一段时间后,再把小烧杯放回托盘天平上,天平是否仍然平衡?
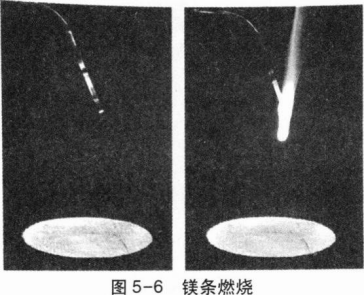
实验5-2取一根用砂纸打磨干净的长镁条和一个石棉网,将它们一起放在托盘天平上称量,记录所称的质量。在石棉网上方将镁条点燃(如图5-6),观察现象。
将镁条燃烧后的产物与石棉网一起放在托盘天平上称量,比较反应前后的质量。
要求:
(1)谈谈你对“质量守恒定律”一课在初中化学体系中的教学价值的认识。
(2)根据以上材料完成“质量守恒定律”的教学设计,包括教学目标、教学重点、教学难点、教学方法、教学过程等方面(不少于300字)。
正确答案及解析
正确答案
解析
解析:(1)“质量守恒定律”一课在初中化学体系中有承上启下的作用。在本节课之前,学生已经学习了一些化学知识,知道了物质经过化学反应可以生成新的物质,但是并没有涉及反应物与生成物之间量的关系。而本节课是从生成何种物质向生成多少物质的一个过渡,可以引导学生从量的方面去研究化学反应的客观规律,为化学方程式的书写和计算做好理论准备。
(2)教学设计
①教学目标
知识与技能:认识质量守恒定律,并能使用质量守恒定律解释化学反应中的实验现象;学会用微观的观点解释质量守恒定律。
过程与方法:通过对化学反应实质的分析及质量守恒原因的分析,培养研究问题的能力和逻辑推理的能力;通过对实验的观察,培养观察分析的能力。
情感态度与价值观:通过观察实验现象从而得出质量守恒定律,培养研究问题的科学态度;通过对化学反应中反应物和生成物质量的测量,培养唯物主义世界观。
②教学重、难点
教学重点:质量守恒的含义及应用。
教学难点:质量守恒定律的理解。
③教学方法
观察法、实验探究法等。
④教学过程
环节一:导入新课
【创设问题情境】从前面的学习中我们知道,在一定的条件下,反应物之间发生化学反应可以生成新物质。
如红磷燃烧生成五氧化二磷,表示为P+O2 P2O5;铁和硫酸铜反应生成铜和硫酸亚铁,表示为Fe+CuSO4→Cu+FeSO4。那么,大家猜想一下,在这些反应中反应前后各物质的质量总和有什么变化呢?
P2O5;铁和硫酸铜反应生成铜和硫酸亚铁,表示为Fe+CuSO4→Cu+FeSO4。那么,大家猜想一下,在这些反应中反应前后各物质的质量总和有什么变化呢?
【学生猜想、讨论】
【共同总结】可能有的三种情况:①生成物的质量总和大于反应物的质量总和;②生成物的质量总和小于反应物的质量总和;③生成物的质量总和等于反应物的质量总和。
【教师引导】反应物的质量总和与生成物的质量总和到底是一种什么关系呢?大于、等于,还是小于?我们来进行下面的活动与探究,通过实验去验证一下反应物的质量和生成物的质量的关系。
环节二:讲授新课
【活动与探究】
1.红磷燃烧前后质量总和如何变化?
2.铁与硫酸铜反应,生成物的质量总和与反应物的质量总和之间的关系。
【教师说明】实验分两大组进行,第一组进行实验一,第二组进行实验二。
【教师强调注意事项】
1.称量时天平应注意调零;
2.红磷燃烧时,锥形瓶底部应预先装一些沙子;
3.红磷燃烧这个实验中,点燃燃烧匙内的红磷后往锥形瓶中塞时动作要快,塞子要塞紧,不能漏气;
4.在铁与硫酸铜反应这个实验中,铁钉在放入硫酸铜溶液之前,要用砂纸打磨干净。
【学生实验,教师巡视,及时发现学生操作中的一些错误并进行纠正】
【学生陈述实验结果】
【教师引导并总结】通过这两个实验我们看到,发生化学反应时,参加反应的反应物的质量总和与生成物
的质量总和存在相等的关系。其实不仅仅这两个实验如此,无数的实验证明,反应前后参加化学反应的反应
物和生成物的质量总和相等,这个规律叫作质量守恒定律。
【板书】课题1质量守恒定律
【教师设问】有了前面的实验作基础,我们该如何去描述质量守恒定律的内容呢?
【板书】一、质量守恒定律
【学生思考、回答】
【教师总结并板书】1.内容:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
这个规律就叫作质量守恒定律。
【教师设问】现有一反应A+B→C,有10?g A和5gB反应,反应结束后还剩余3g?A,B无剩余,则生成C的质量为多少克?
【学生思考、回答】
【教师强调】质量守恒定律指的是参加反应的各物质的质量总和,而不是有多少反应物,一定要注意“参加”二字的真正含义。
【教师介绍】质量守恒定律是十八世纪的重要发现之一,它把对化学的学习由生成何种物质(即质的研究)引向生成多少物质(即量的研究),具有非常重要的意义。那么质量守恒定律是谁发现的,又是如何发现的呢?请阅读课本资料。
【学生阅读】
【教师引导】了解了质量守恒定律的内容和它的发现,我们再从微观方面来研究一下为什么在化学反应中参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。请看投影。
【多媒体投影】展示红磷燃烧和铁与硫酸铜反应的微观过程,从分子、原子角度进行分析。
【教师设问】从投影所展示的分子和原子的角度思考为什么化学反应都遵守质量守恒定律?
【学生思考、讨论】
【教师引导并总结】从微观过程以及前面所学的分子、原子知识可知,化学反应的过程,实际上是旧的分子破裂,原子和原子重新组合成新的分子的过程。在这个过程中,原子的种类没有变化,原子的数目没有增减,原子的质量也没有变化,所以反应物的质量总和会等于生成物的质量总和。
【板书】2.微观解释:在化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有改变。
【教师设问】到底是不是所有的化学反应都遵守质量守恒定律呢?我们再来进行下面的活动与探究,验证一下质量守恒定律是否正确。
【活动与探究】(仍分两大组进行实验)
1.蜡烛燃烧前后是否遵守质量守恒定律?
2.镁带在空气中燃烧,反应物的质量之和与生成物的质量之和是否相等?
【学生实验,教师巡视,及时发现学生操作中的一些错误并进行纠正】
【学生陈述实验结果】
【教师引导并总结】1.蜡烛燃烧前后不遵守质量守恒定律,生成物的质量小于反应物的质量。
2.镁带在空气中燃烧也不遵守质量守恒定律,生成物的质量大于反应物的质量。
【教师设问】讨论一下这是为什么呢?为什么会出现生成物的质量大于或小于反应物的质量的这些情况?
【学生讨论、回答】
【教师引导并总结】1.在蜡烛燃烧这个实验中,生成物二氧化碳和水蒸气都是气体,挥发到了空气中,所以会出现生成物的质量小于反应物的质量的这种情况。
2.在镁带燃烧这个实验中,因为反应物有空气中的氧气参加,而我们反应前所称量的仅仅是镁带的质量,所以会出现生成物的质量大于反应物的质量的这种情况。
【教师追问】这两个反应到底遵守不遵守质量守恒定律呢?
【学生讨论、回答】
【教师引导并总结】遵守。只要改进实验装置,就会出现正确的结果。
【教师设问】如何改进实验装置呢?
【学生思考、讨论】
【教师引导并总结】1.蜡烛的燃烧可以在一个密闭的容器中进行,比如采用红磷燃烧的装置,就会得到正确的结果。
2.镁带的燃烧也应在一个密闭容器中进行,塞子中央应该有孑L,然后系一小气球。
【展示改进装置】
【教师介绍】我这里有一改进的蜡烛燃烧的装置,大家请看。取一密闭小试剂瓶,待蜡烛燃烧后迅速地放入瓶中并塞紧瓶口。
环节三:巩固提高
【练习】1.在下列各项中,化学反应前后肯定没有发生改变的是( )。
①原子的数目②分子的数目
③元素的种类④物质的总质量
⑤物质的种类⑥原子的种类
你可能感兴趣的试题
有“泥土诗人”之称的诗人是()。
-
- A.臧克家
- B.田间
- C.艾青
- D.许地山
- 查看答案
将下列各项按所表示年龄大小顺序排列,正确的顺序应是( )。
①不惑②垂髫③花甲④加冠⑤而立⑥古稀⑦半百
-
- A.②④①⑦⑤③⑥
- B.④②③⑥①⑦⑤
- C.⑥⑤③②④⑦①
- D.②④⑤①⑦③⑥
- 查看答案
钱穆在评论中国古代某制度时说,它“可以培植全国人民对政治之兴味……可以团结全国各地域于一个中央之统治”,这一制度是()。
-
- A.郡县制
- B.察举制
- C.科举制
- D.行省制
- 查看答案
明朝初年强化君主专制的措施是()。
-
- A.增设军机处
- B.采用三省六部制
- C.废除丞相.权分六部
- D.设中书省为全国最高行政机构
- 查看答案
1931年,一位给人们带来光明的科学家重病的消息牵动着世界人民的心,几十名记者为他守夜。每隔一个小时就对外发布一次消息:“灯”还亮着。这位科学家是( )。
-
- A.瓦特
- B.法拉第
- C.爱迪生
- D.爱因斯坦
- 查看答案