“侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3═NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是( )
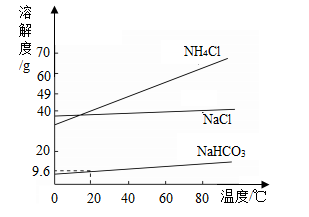
- A.0℃时,NH4Cl的溶解度大于NaCl的溶解度
- B.20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数
- C.20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出
- D.NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl
正确答案及解析
正确答案
解析
【分析】根据固体的溶解度曲线可以知道:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性;②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。根据题目信息和溶解度曲线可知:氯化铵、氯化钠、碳酸氢钠三种固体物质的溶解度,都是随温度升高而增大,而氯化钠的溶解度随温度的升高变化比较小。
【解答】解:A、由溶解度曲线可知,0℃时,NH4Cl的溶解度小于NaCl的溶解度,故A错;
B、因为20℃时,NH4Cl的溶解度大于NaHCO3的溶解度,所以20℃时,NaHCO3饱和溶液中溶质的质量分数不一定大于NH4Cl不饱和溶液中溶质的质量分数,故B错;
C、20℃时,NaHCO3的溶解度是9.6g,即在该温度下,100g水中最多溶解9.6gNaHCO3,5.85g NaCl和7.9g NH4HCO3反应能生成8.4gNaHCO3,所以20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,得到NaHCO3的不饱和溶液,不能析出NaHCO3晶体,故C错;
D、NH4Cl溶解度受温度影响较大,NaCl的溶解度受温度影响较小,所以NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl,故D正确。
故选:D。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和结晶的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.
包含此试题的试卷
你可能感兴趣的试题
“侯氏制碱法”生产纯碱的主要反应是NaCl+NH4HCO3═NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线。下列叙述正确的是( )

-
- A.0℃时,NH4Cl的溶解度大于NaCl的溶解度
- B.20℃时,NaHCO3饱和溶液中溶质的质量分数一定大于NH4Cl不饱和溶液中溶质的质量分数
- C.20℃时,100g水中加入5.85g NaCl和7.9g NH4HCO3固体,肯定有NaHCO3晶体析出
- D.NH4Cl固体中含有少量的NaCl,可用降温结晶的方法提纯NH4Cl
- 查看答案
下列叙述正确的是( )
-
- A.
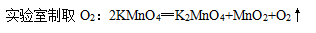
- B.工业上分离液态空气得到O2的变化属于化学变化
- C.自然界中植物通过光合作用吸收CO2,释放O2
- D.人体呼出的气体中CO2的含量比O2高
- A.
- 查看答案
如图是甲和乙在一定条件下反应前后分子种类变化的微观示意图。下列叙述正确的是( )
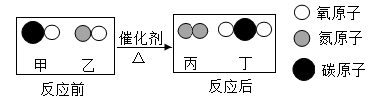
-
- A.甲与丙均属于氧化物
- B.反应生成的丙与丁的分子个数比为1:1
- C.反应后原子的数目增加
- D.该反应能使有害气体转化为无害物质
- 查看答案
下列物质的性质与用途对应关系正确的是( )
-
- A.石墨有导电性,可用于生产铅笔芯
- B.银有金属光泽,可用于制造电线
- C.二氧化碳能与水反应,可用于灭火
- D.熟石灰溶液有碱性,可用于改良酸性土壤
- 查看答案
丙氨酸(C3H7O2N)是一种常见的氨基酸。下列叙述正确的是( )
-
- A.丙氨酸属于有机小分子化合物
- B.丙氨酸是一种蛋白质
- C.每个丙氨酸分子中含有1个氧分子
- D.丙氨酸中碳、氮元素的质量比为3:1
- 查看答案