某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。下列叙述中不正确的是( )。
- A.外层电子排布为3d54s1
- B.该元素为第四周期、ⅥB族元素铬
- C.+3价离子的外层电子排布式为3d24s1
- D.该元素的最高价氧化物的水合物为强酸
正确答案及解析
正确答案
C
解析
根据题意,最高氧化数为+6的元素有VIA族和VIB族元素;而已知最外层只有一个电子,故只能是VIB族元素;在由已知中最后一个条件“原子半径是同族元素中最小的”,可确定该元素是VIB组中的Cr,Cr的电子排布式为
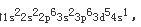
,可得出以下结论:
外层电子排布
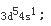
因为周期数等于电子层数,等于最高主量子数,即第四周期。他的最后一个电子填充在d亚层上,所以它是副族元素,其族数等于[(n-1)d+ns]电子层上的电子数,对Cr来讲为5+1=6,即ⅥB族元素;
因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为
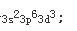
Cr的最高价氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。
包含此试题的试卷
你可能感兴趣的试题
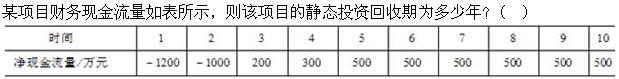
-
- A.5.4
- B.5.6
- C.7.4
- D.7.6
- 查看答案
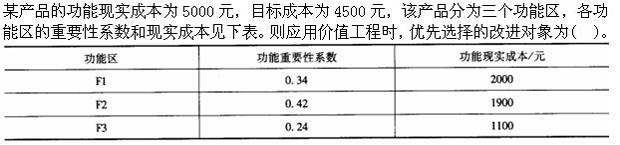
-
- A.F1
- B.F2
- C.F3
- D.F1、F2和F3
- 查看答案
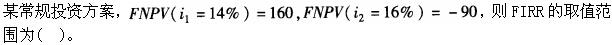
-
- A.<14%
- B.14%~15%
- C.15%~16%
- D.>16%
- 查看答案
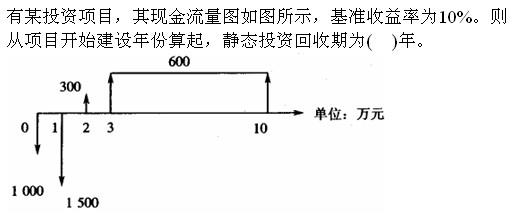
-
- A.5.67
- B.3.67
- C.4.55
- D.6.78
- 查看答案
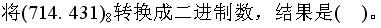
-
- A.111001100.100011001
- B.111001100.10001101
- C.111001100.100011011
- D.111001100.10001111
- 查看答案