将6 mL 0.2 mol/L盐酸与10 mL 0.1 mol/L氨水混合,完全反应后,溶液中各种离子浓度的相对大小是.
正确答案及解析
正确答案
解析
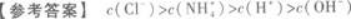 【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:
【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:

根据HCl和NH3的数量的不同.可能有三种情况:
①恰好完全反应,此时就变成NH4Cl溶液;
②HCl有剩余,此时就是NH4Cl和HCl的混合溶液;
③NH3有剩余,此时就是NH4Cl与NH3的混合溶液.
(2)盐酸中HCl的物质的量为:0.2 mol/L×0.006 L=0.001 2 mol.
氨水中NH3的物质的量为:0.1 mol/L×0.01 L=0.001 mol.
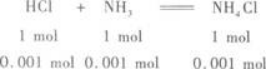
所以,反应后生成NH4Cl 0.001 mol,剩余的HCl为0.001 2 mol-0.001 mol=0.000 2 mol.
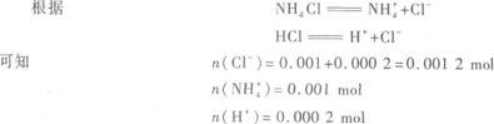
以上物质的量的大小顺序就是离子浓度的大小顺序.
另外,一般情况下,溶液均指水溶液,所以溶液中还有水电离出来的H+和OH-两种离子
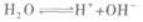
此题中酸有剩余,所以c(H+)一定大于c(OH-).