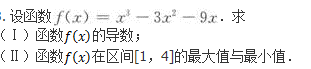等体积混合0.1 mol/L盐酸和0.06 mol/L氢氧化钡溶液,混合后溶液的pH=____________.
正确答案及解析
正确答案
解析
12【解题指要】
(1)设酸和碱溶液的体积均为1 L,则盐酸溶液中含HCl为0.1 mol/L×1 L=0.1 mol;
Ba(OH)2溶液中含Ba(OH)2为0.06 mol/L×l L=0.06 mol.
(2)两溶液混合时,要发生化学反应

因此,混合后可能有以下三种情况:
①恰好完全反应.因BaCl2是强酸强碱盐,所以溶液显中性.
②酸有剩余,溶液显酸性.
③碱有剩余,溶液显碱性.
究竟属于哪一种情况,需经计算才能知道.
设与盐酸完全反应需Ba(OH)2xmol,则
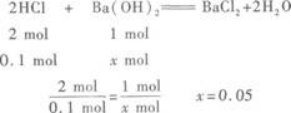
所以Ba(OH)2剩余:0.06 mol-0.05 mol=0.01mol.
(3)计算混合后溶液的pH.

OH一的物质的量浓度为0.005 mol/L×2=0.01mol/L,则
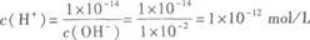
即pH=12.